قانون بویل

رابرت بویل این قانون را در سال 1662، با دادن رابطه ای بین فشار و حجم جرمی معین از یک گاز در دمای ثابت، پیشنهاد کرد.

این قانون بیان می کند که در دمای ثابت حجم جرمی معین از گاز با فشار آن گاز به طور عکس متناسب است که به صورت زیر بر قرار است :
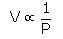
در شرایطی که دما ثابت است و یا PV = K = ثابت. زمانی که در یک دمای معین فشار گاز از P1 به P2 تغییر کند، رابطه می نتیجه شود:
P1V1 = P2 V2 = ثابت
در جایی که V2 حجم نهایی گاز محسوب می شود. حاصل ضرب حجم و فشار یک جرم معین از گاز در دمای ثابت، یک مقدار ثابتی می شود. از نظر آزمایشگاهی می توان این مسئله را با تهیه کردن نمودار فشار - حجم برای 10g از گاز اکسیژن در دمای 25 درجه سانتی گراد تأیید کرد. در نهایت مشاهده خواهد شد که با افزایش فشار، حجم کاهش می یابد و حاصل ضرب PV به صورت ثابت برقرار می گردد.

شکل 1 - تغییر فشار و حجم در دمای ثابت

ادامه مطلب |